La peste porcine africaine (PPA) est une maladie contagieuse spéciale aux suidés, due à un virus de la famille des Asfarviridae.
Comme la peste porcine classique (PPC), elle se présente dans sa forme la plus caractéristique comme une maladie d’allure épizootique associant une atteinte générale fébrile à des symptômes oculaires, cutanés, digestifs, respiratoires et nerveux diversement associés, et provoque une mortalité élevée en une dizaine de jours en moyenne, avec des lésions hémorragiques (en particulier des nœuds lymphatiques, reins, rate, vessie et amygdales).
Maladie à taux élevé de morbidité et de mortalité (le taux de mortalité peut atteindre 100%), la PPA est un fléau majeur de l’élevage porcin (aucune possibilité de métaphylaxie).
ESPÈCES AFFECTÉES
La PPA touche exclusivement les suidés. Le porc et le sanglier sont très sensibles ; en revanche, différents suidés africains (phacochères, potamochères et hylochères) font une infection inapparente (rôle de réservoir).
N’affecte pas l’homme.
ETIOLOGIE
La PPA est due à un virus (genre Asfivirus) fondamentalement distinct du virus de la peste porcine classique ; il s’agit d’un virus à ADN, à symétrie cubique, enveloppé de 200 nm de diamètre, seul représentant de la famille des Asfarviridae.
Le virus induit in vivo des anticorps mais pas la formation d’anticorps neutralisants.
L’injection du virus inactivé n’entraîne pas d’immunité .
Il n’existe donc actuellement aucune possibilité de prophylaxie médicale.
ÉTUDE CLINIQUE
Incubation : de l’ordre de 3 à 15 jours (maximum 40 jours)
Symptômes
- Maladie cliniquement indifférenciable de la peste porcine classique (PPC) : atteinte générale fébrile et symptômes respiratoires, digestifs, nerveux et cutanés diversement associés, évoluant vers la mort en quelques jours à plusieurs semaines selon la forme évolutive (suraiguë, aiguë, subaiguë)
- Noter l’importance des symptômes hémorragiques (purpura, hématémèse, hématomes auriculaires) et des symptômes respiratoires dans les formes aiguës.
- Noter le caractère fruste des formes chroniques, dominées par des symptômes de pneumonie,
- Évoluant en 2 à 15 mois vers la cachexie et la mort.
LÉSIONS
- lésions indifférenciable de la PPC : tableau de septicémie hémorragique (aspect congestif ou hémorragique des nœuds lymphatiques, hémorragies rénales visibles après décapsulation des reins, infarctus spléniques, amygdalite hémorragique).
- des lésions hémorragiques plus marquées avec infiltrations hémorragiques des nœuds lymphatiques, épanchements hémorragiques dans les grandes cavités, hématomes
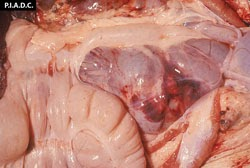
- une splénomégalie fréquente (rate hypertrophiée, hémorragique)
- des œdèmes localisés (œdèmes d’aspect gélatineux) : œdème de la paroi de la vésicule biliaire,
- œdème de la paroi du tube digestif, œdèmes sous-cutanés.
- lésions non spécifiques de pneumonie dans les formes chroniques.
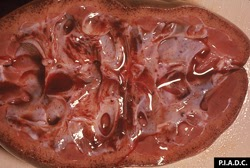
rein. Le cortex contient des pétéchies disséminées. Les calyces sont modérément dilatés (hydronéphrose) et contiennent également des hémorragies
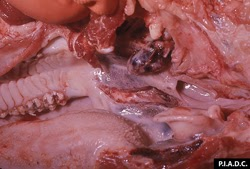
ganglion rétropharyngé. Le ganglion lymphatique est nettement élargi et hémorragique; l’amygdale contient plusieurs hémorragies mal démarquées
rein. Il y a une hémorragie étendue sur la surface corticale
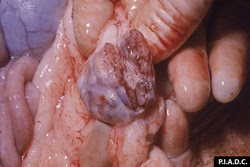
ganglion inguinal. Il existe des hémorragies pétéchiales et périphériques (sinus médullaire)
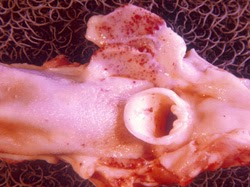
pharynx et larynx. Des hémorragies pétéchiales et des nécroses se développent dans les amygdales palatines et les muqueuses pharyngée et laryngée adjacentes
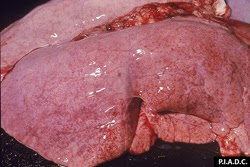
poumons. Les pétéchies pleurales disséminées sont nombreuses et il existe un léger œdème interlobulaire.
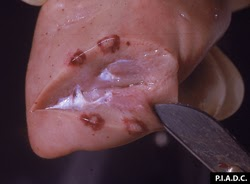
rein. Le cortex contient de multiples pétéchies et infarctus pâles entourés d’hémorragies
rein. Le cortex contient de multiples pétéchies et infarctus pâles entourés d’hémorragies.
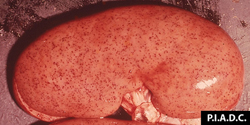
rein. Il existe de nombreuses pétéchies corticales disséminées (« rein d’œuf de dinde »)
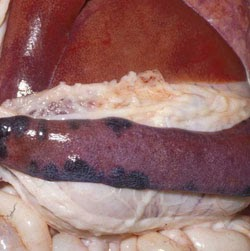
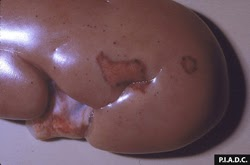
rate. Il existe de multiples infarctus coalescents, gonflés et rouge foncé le long des marges
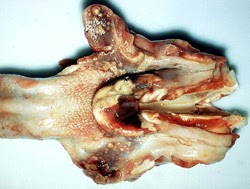
amygdales. L’épiglotte et l’amygdale palatine bissectée contiennent de multiples foyers de nécrose bronzés
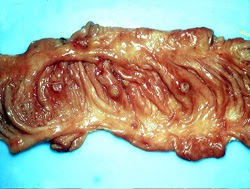
amygdales. L’épiglotte et l’amygdale palatine bissectée contiennent de multiples foyers de nécrose bronzés
ÉPIDÉMIOLOGIE
Sources de germes :
- malades : tous les tissus (le sang en particulier), excrétions et sécrétions sont virulents.
- suidés infectés inapparents : cas des suidés sauvages en Afrique (réservoir). Portage inapparent possible chez le porc ou le sanglier.
- argasidés : Ornithodoros moubata en Afrique, Ornithodoros erraticus en Espagne et au Portugal, etc. assurent la multiplication du virus avec transmission transovarienne.
Virus très résistant
- aussi bien dans le milieu extérieur que dans les produits d’origine animale (2 à 3 mois dans les cadavres et les porcheries, 3 mois dans le jambon fumé, 6 mois dans la moelle osseuse du jambon, 18 mois dans le sang desséché).
Transmission :
- directe (contact)
- indirecte soit par le milieu extérieur ou les aliments, soit par vecteur biologique (ornithodores). Voies de pénétration variées (digestive, respiratoire, transcutanée).
En Europe: la maladie peut s’entretenir dans les populations de sangliers. Importance fondamentale des viandes et produits de charcuterie dans la diffusion du virus (eaux grasses). Importance de la commercialisation de porcs infectés.
DIAGNOSTICS DIFFÉRENTIELS
- le diagnostic clinique différentiel PPC/PPA n’étant pas possible. Ils conduisent à une suspicion de « peste porcine ».
- relations épidémiologiques avec un pays infecté, phénomènes hémorragiques intenses, œdème de la paroi de la vésicule biliaire, etc.
Attention : Le diagnostic différentiel des pestes porcines classique ou africaine ne peut se faire que sur diagnostic de laboratoire.
Le diagnostic différentiel avec d’autres maladies dites « rouges » est très délicat sur le terrain sans avoir recours à un diagnostic de laboratoire, seul un contexte épidémiologique particulier pourrait orienter la suspicion vers une autre maladie comme le SDRP, la dermatite néphrite (PDNS) due au circovirus porcin de type 2 ou d’autres maladies bactériennes comme celles dues à Streptococcus suis, Actinobacillus pleuropneumoniae, ou Erysipelothrix rhusiopathiae.
Une mortalité massive et collective sur quelques jours peut également être liée à une intoxication ou un empoisonnement.
CRITÈRES DE SUSPICION
Vidéo « Signes d’alerte et prélèvements » : Visionnez ici
Le contexte épidémiologique (absence apparente de facteurs de risque tels qu’introduction d’animaux, contacts avec la faune sauvage, etc.) ne doit pas moduler la déclaration d’une suspicion au risque d’écarter des suspicions par défaut. En effet, par définition, les circonstances d’apparition d’une maladie exotique ne sont pas connues à l’avance.
Les tableaux cliniques et lésionnels de la PPA sont présentés en annexe . Les critères de suspicion clinique de pestes porcines devant faire l’objet d’un signalement immédiat à la direction départementale en charge de la protection des populations (DDecPP) lorsqu’ils sont relevés en élevage sont présentés ci-dessous.
Critères de suspicion clinique en élevage de porcs domestiques
Observation le jour de l’examen ou dans les commémoratifs au cours du mois précédent de plusieurs animaux dans l’élevage, présentant des signes généraux :
- chez les porcs en croissance : appétit diminué, hyperthermie, regroupements des
- animaux, apathie, dyspnée, ataxie, augmentation importante de la consommation d’eau (si mesurable)
- chez les animaux reproducteurs : ces mêmes signes cliniques et/ou des avortements et/ou une forte mortalité sous la mère,
- et/ou lésions hémorragiques externes (rougeurs des extrémités et de la partie déclive de l’abdomen, hémorragies (pétéchies) sur les oreilles et sur le reste du corps),
OU
Enregistrement sur une période de 15 jours d’une mortalité au moins deux fois plus importante que la mortalité moyenne habituellement observée (en excluant les porcelets de moins d’un mois) en prenant en compte la plus petite unité épidémiologique de l’élevage (de la plus petite à la plus grande : salle, bande, atelier).
OU
Observation de lésions internes caractéristiques de PP sur au moins un porc autopsié*.
Les lésions caractéristiques à prendre en compte sont :
- Splénomégalie : rate plus large et/ou de structure modifiée (boueuse, friable), et/ou
- Nœuds lymphatiques hypertrophiés congestionnés, hémorragiques, et/ou
- Rein hypertrophié avec pétéchies, et/ou
- Face interne de la vessie hémorragique.
ET
Absence de diagnostic différentiel (cf. annexe) d’exclusion avéré (identification d’une autre étiologie avec certitude)**.
* Autopsies en élevage est encouragée sans retardent la suspicion de PP basée sur des critères cliniques ou de mortalité, conditions de biosécurité (fiche de bonne pratique d’autopsie SNGTV).
Les autopsies peuvent être réalisées en laboratoire vétérinaire (biosécurité du transport de cadavre)
** Attention : concernant le 4ème critère, il conviendra de ne se baser que sur les informations existantes le jour du signalement par le vétérinaire et de ne pas mettre en œuvre d’examens complémentaires qui pourraient retarder l’émission de la suspicion. Pour qu’une suspicion de Peste Porcine ne soit pas posée suite à l’observation des deux premiers critères, le diagnostic d’exclusion doit être certain. Cela sous-entend que le tableau clinique est caractéristique d’une autre affection. S’il y a le moindre doute, une suspicion de peste porcine doit être posée.
Critères de suspicion clinique en élevages familiaux
La présence sur un seul porc ne signes cliniques évocateurs généraux accompagnés de lésions externes voire de lésions internes observés suite à une autopsie doit amener vétérinaire à poser une suspicion de PP et informer la DDCSPP.
Critères de suspicion clinique en élevage de sangliers
Mortalités « inhabituelles », non spécifiques d’une tranche d’âge,
OU
Observation le jour de l’examen ou dans les commémoratifs au cours du mois précédent de plusieurs animaux dans l’élevage présentant des signes généraux : comportement lié à l’hyperthermie (ex : recherche de points d’eau), apathie, ataxie.
OU
Observation de lésions internes caractéristiques de PP sur au moins un sanglier autopsié*. Les lésions caractéristiques à prendre en compte sont :
- Splénomégalie : Rate plus large et/ou de structure modifiée (boueuse, friable), et/ou
- Ganglions hypertrophiés congestionnés, hémorragiques, et/ou
- Rein hypertrophié avec pétéchies, et/ou
- Face interne de la vessie hémorragique.
ET
Absence de diagnostic différentiel (cf. annexe 3) d’exclusion avéré (identification d’une autre étiologie avec certitude)**.
- Document des critères cités ci-dessus – Cliquez ici.
CONSIGNES BIOSÉCURITÉ
- Biosécurité autopsie : SNGTV – Fiche technique : « PP_Biosecurite_Autopsie» Cliquez ici
- Consignes à l’éleveur (pour INFO – Soumis décision de la DDCSPP) : DGAL « PP_Consigne_Eleveur_sequest»Cliquez ici
PRÉLÈVEMENTS (pour INFO – Soumis à la décision de la DDETSPP)
- toute suspicion entraîne obligatoirement un diagnostic expérimental de certitude.
- en cas de suspicion, prélèvements identiques à ceux de la PPC (reins + rate + ganglions + amygdales + éventuellement sang sur anticoagulant de porcs fébriles pour diagnostic virologique, sang sur tube sec pour diagnostic sérologique).
Le diagnostic expérimental est, selon le cas, virologique et/ou sérologique







Comments are closed